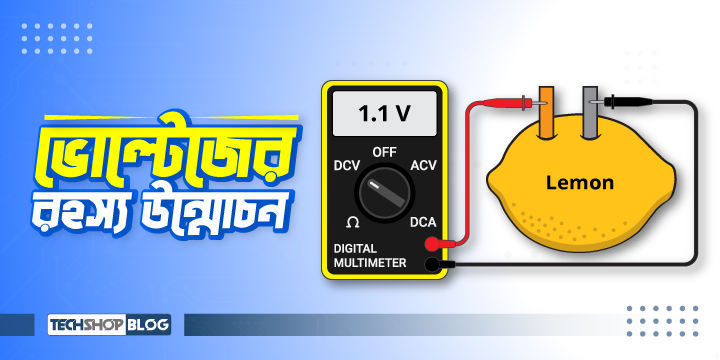
তামার ভিতরে বিদ্যুৎ প্রবাহ এবং মুক্ত ইলেকট্রনের কার্যকারিতা বোঝার জন্য, আমাদের পদার্থের গঠন ও পরমাণুর অভ্যন্তরীণ কাঠামো সম্পর্কে ধারণা থাকা প্রয়োজন। তামা আমাদের দৈনন্দিন জীবনে গুরুত্বপূর্ণ, কারণ এটি একটি বিদ্যুৎ সুপরিবাহী পদার্থ। আমরা জানি বাড়ি তৈরির জন্য ইট, বালু ও সিমেন্টের মতো কঠিন পদার্থ ব্যবহার হয়। আবার তরল পদার্থ হিসেবে আমরা প্রতিদিন পানি ও জুস পান করি। অপরদিকে রান্নায় বায়বীয় পদার্থ যেমন গ্যাস ব্যবহার করে থাকি। পদার্থের এ সকল দশা পারিপার্শ্বিক তাপমাত্রার উপর নির্ভর করে পরিবর্তিত হয়। সাধারণভাবে পদার্থ তিনটি অবস্থায় থাকে যেমন- কঠিন, তরল, ও বায়বীয়। যে কোন পদার্থের ক্ষেত্রেই তাপমাত্রা বৃদ্ধির সাথে সাথে তার অণুগুলো একে অপরের থেকে দূরে সরে যায়। অনুগুলোর এই দূরত্বের কারণেই পদার্থ কখনো কঠিন (যেমনঃ বরফ), কখনো তরল (যেমনঃ পানি), আবার কখনো বায়বীয় (যেমনঃ বাষ্প) ইত্যাদি অবস্থায় রূপ নেয়।
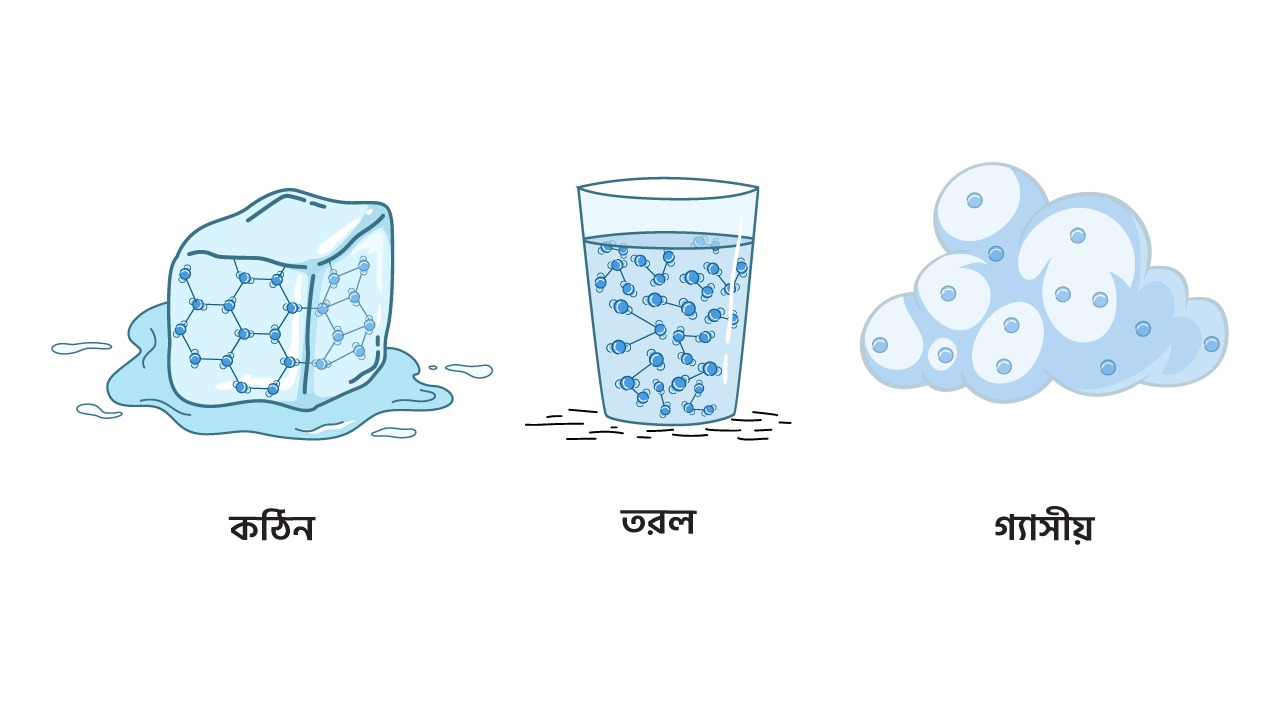
চিত্র ১.১ঃ কঠিন, তরল ও বায়বীয় পদার্থ
এই বরফ, পানি এবং বাষ্প হলো একই পদার্থ যেমন পানির তিনটি ভিন্ন ভিন্ন দশা।
পরমাণুর অভ্যন্তরীণ গঠন
ভোল্টেজ সম্পর্কে বিস্তারিত জানতে হলে, আমাদের প্রথমে পদার্থের অভ্যন্তরীণ গঠন বুঝতে হবে। পদার্থের মৌলিক অংশ হলো পরমাণু, যা অভ্যন্তরে একটি কেন্দ্রীয় নিউক্লিয়াস ধারণ করে। নিউক্লিয়াস প্রোটন এবং নিউট্রন দ্বারা গঠিত। যা একটি শক্তিশালী আকর্ষণ বল দ্বারা কেন্দ্রের সাথে সংযুক্ত থাকে।
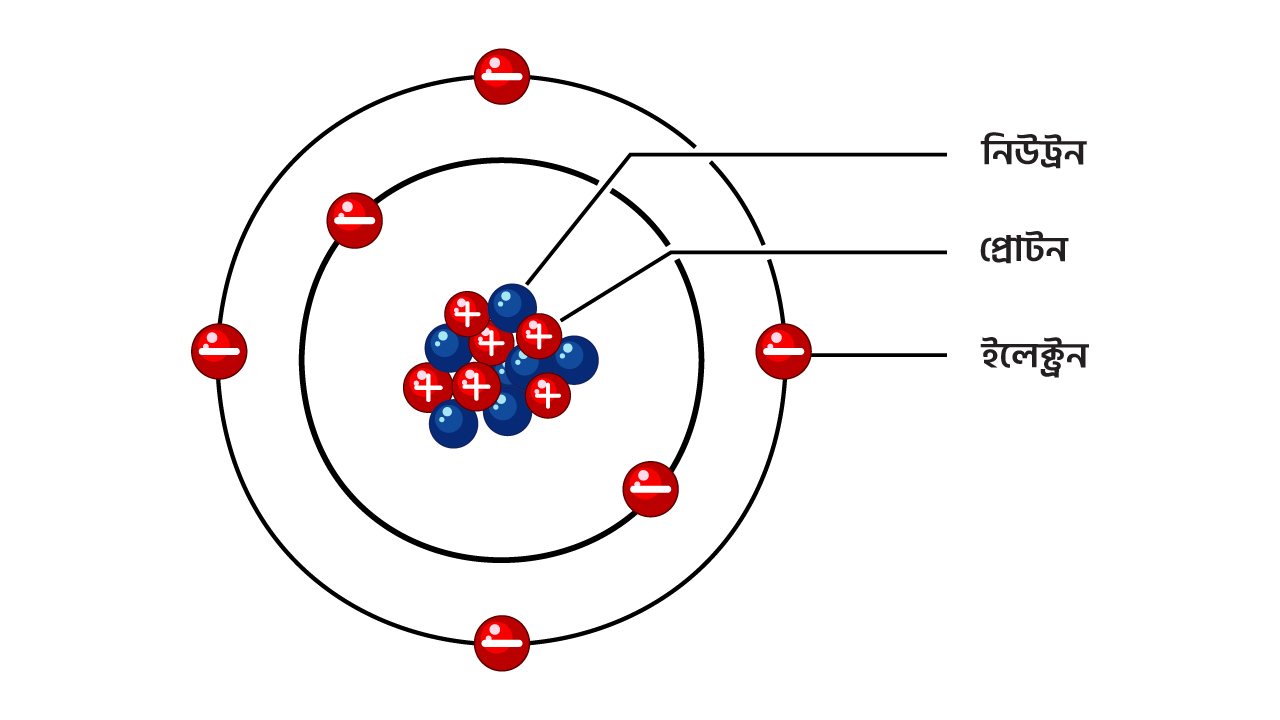
চিত্র ১.২ঃ পরমাণুর অভন্ত্যরীন গঠন
পরমাণুর গঠন ও বৈদ্যুতিক প্রবাহ
পরমাণুর একটি কক্ষপথে সর্বোচ্চ কতগুলো ইলেকট্রন থাকবে তা 2n2 সূত্রের মাধ্যমে নির্ণয় করা যায়। যেখানে n হল কক্ষপথ (শেল) এর সংখ্যা। শেল গুলো K শেল, L শেল, M শেল, N শেল, ইত্যাদি নামে চিহ্নিত করা হয়।
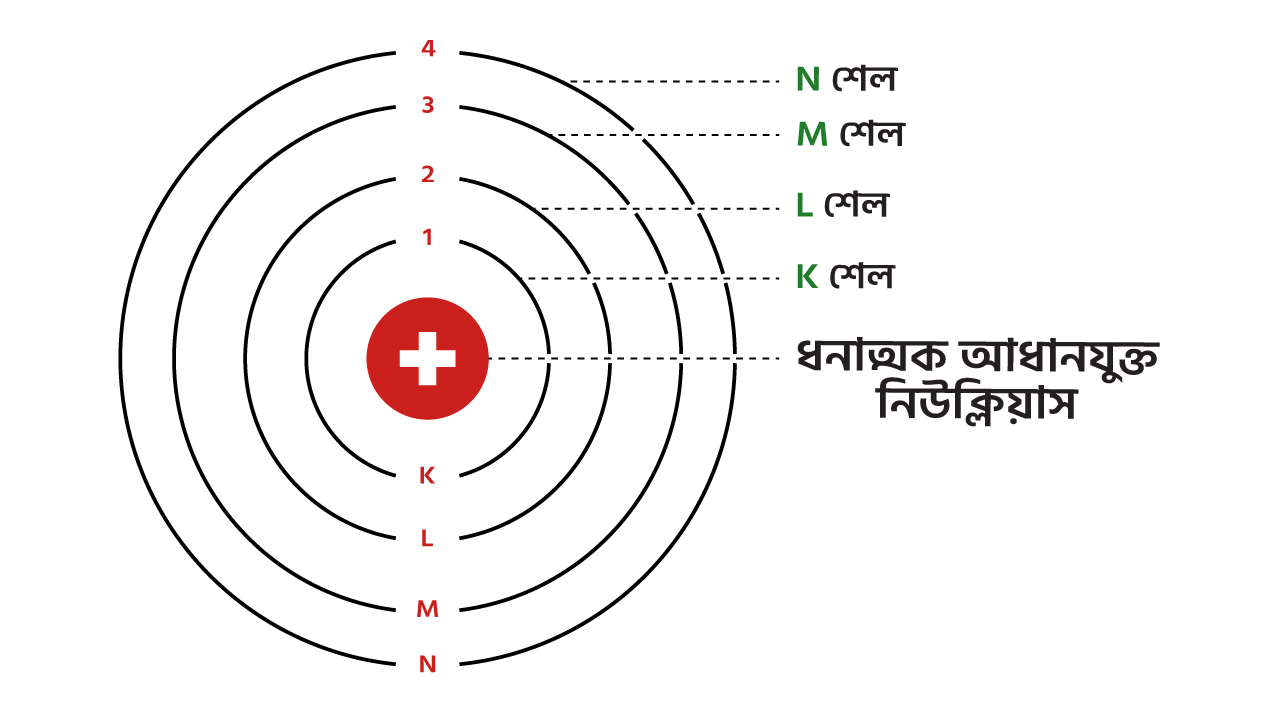
চিত্র ১.৩ঃ ইলেক্ট্রনের কক্ষপথ (শেল)
| প্রধান শক্তিস্তর (n) | সর্বোচ্চ ইলেক্ট্রন সংখ্যা (2n2) | |
| ১ | ২ x ১2 | ২ |
| ২ | ২ x ২2 | ৮ |
| ৩ | ২ x ৩2 | ১৮ |
| ৪ | ২ x ৪2 | ৩২ |
| ৫ | ২ x ৫2 | ৫০ |
| ৬ | ২ x ৬2 | ৭২ |
| এভাবে চলবে….. | ||
সারণিঃ প্রধান শক্তিস্তর ও সর্বোচ্চ ইলেক্ট্রন সংখ্যা
কপারের মুক্ত ইলেকট্রন
ইতিপূর্বে আমরা অণু এবং পরমাণুর অভ্যন্তরীন গঠন সম্পর্কে জেনেছি। এখন আমরা জানবো, বিভব পার্থক্য কিভাবে বিদ্যুৎ প্রবাহ ঘটায়। উল্লেখ্য, পদার্থের অভ্যন্তরীন গঠন সম্পর্কে ধারণা না থাকলে বিদ্যুৎ প্রবাহ ও বিভব পার্থক্য নিয়ে গভীর জ্ঞান লাভ করা অসম্ভব। বৈদ্যুতিক শিল্পে সবচেয়ে বেশি ব্যবহৃত ধাতু হিসাবে কপার (তামা) বেশ সুপরিচিত। এর একমাত্র কারণ হলো কপার পদার্থে পরমাণুর ইলেকট্রন বিন্যাস। 2n2 সূত্র অনুযায়ী কোন মৌলের শক্তিস্তরের সংখ্যা n বৃদ্ধির সাথে সাথে, এর কক্ষপথে সর্বোচ্চ ইলেক্ট্রন ধারণক্ষমতাও বৃদ্ধি পায়। একই সাথে শক্তিস্তর বৃদ্ধির সাথে সাথে ইলেকট্রনের সাথে নিউক্লিয়াসের দূরত্বও বাড়তে থাকে।
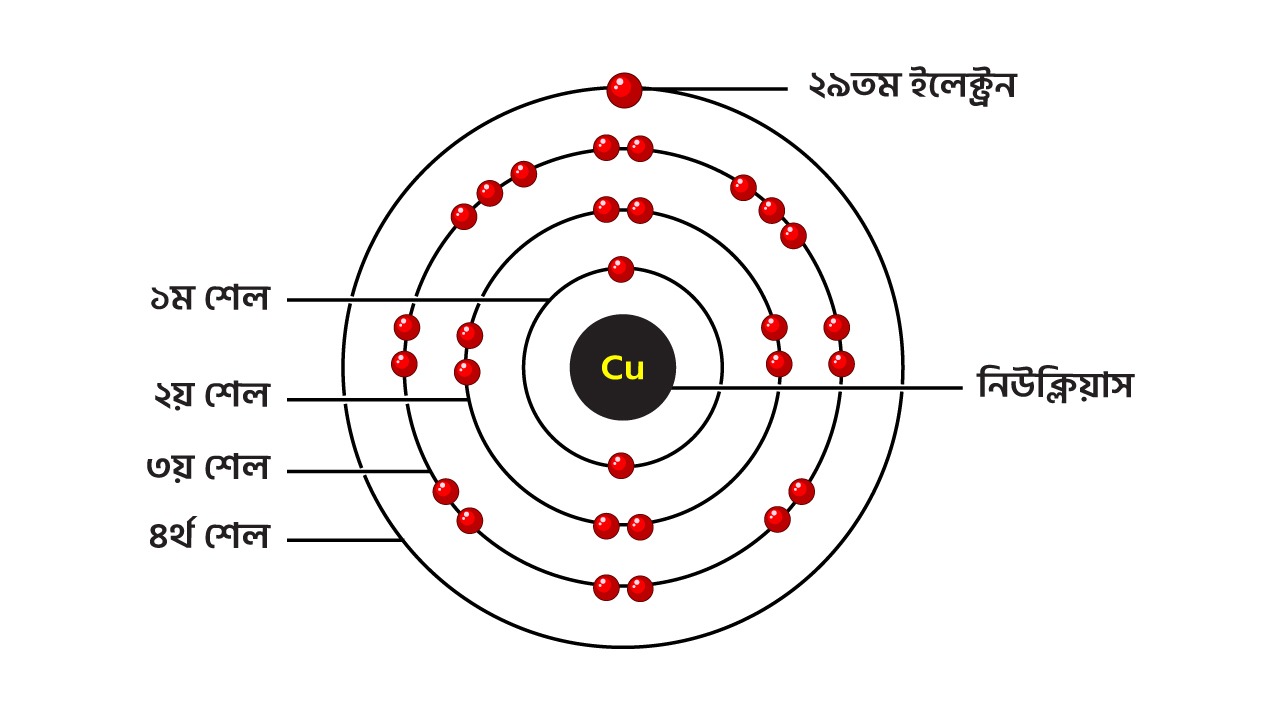
চিত্র ১.৪ঃ কপারের ইলেক্ট্রন বিন্যাস
কপারের বিদ্যুৎ পরিবাহী ক্ষমতা
কপারের ইলেকট্রন বিন্যাস থেকে দেখা যায়, এর শেষ কক্ষপথে একটি মাত্র ইলেকট্রন রয়েছে। পাশাপাশি শেষ কক্ষপথটির অবস্থান নিউক্লিয়াস থেকে বেশ দূরে, ফলে সর্বশেষ ইলেকট্রনটির সাথে নিউক্লিয়াসের আকর্ষণ বল তুলনামূলক কম থাকে । তাই বলা যায় কপারের ২৯ তম ইলেকট্রন এবং নিউক্লিয়াস খবুই দূর্বল বন্ধনে যুক্ত রয়েছে। সামান্য শক্তিতেই এই ইলেকট্রনটি মুক্তভাবে চলাচল শুরু করে।
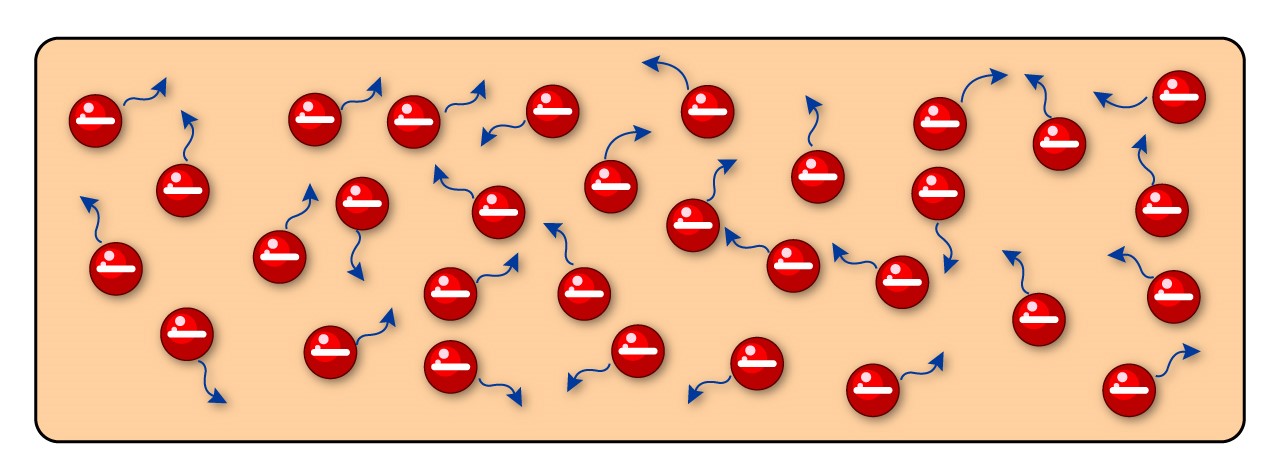
চিত্র ১.৫ঃ মুক্ত ইলেক্ট্রন
পদার্থের ভিতর স্বাধীনভাবে চলাচল করা এই ইলেকট্রন গুলো কে মুক্ত ইলেক্ট্রন (Free Electron) বলে। এই মুক্ত ইলেকট্রনগুলোকে পরিবাহী ইলেকট্রনও বলা হয়, কারণ এরাই বিদ্যুৎ পরিবহন করে।
বিদ্যুৎ প্রবাহে মুক্ত ইলেকট্রনের ভূমিকা
স্বাভাবিক তাপমাত্রায় পদার্থের মধ্যে বিক্ষিপ্ত ভাবে চলাচলা করা এই মুক্ত ইলেকট্রন গুলো বিভব পার্থক্যের সংস্পর্শে আসলেই তাদের দিক পরিবর্তন করে নেয়।
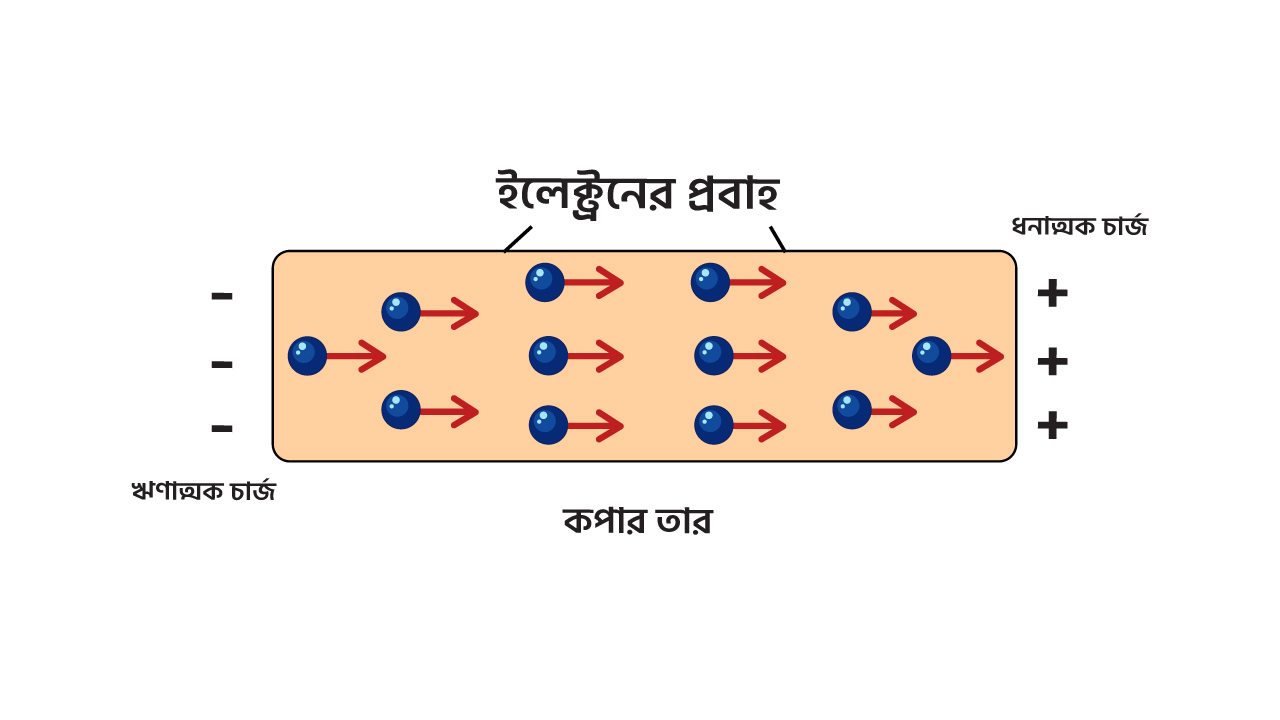
চিত্র ১.৬ঃ তামার তারে বিভব পার্থক্য তৈরী করায় ইলেক্ট্রনের চলাচল
আর এভাবেই বিপরীত ধর্মী চার্জ গুলো একে অপরের দিকে চলাচলের মাধ্যমে বিদ্যুৎ প্রবাহের সৃষ্টি করে।
চিত্র ১.৭ঃ ১ ফিট কপার(তামা) তার
কক্ষ তাপমাত্রায় ১ ফিট কপারের (তামা) তারে প্রায় 1.75 x 1023 টি মুক্ত ইলেক্ট্রন থাকে। যা অসংখ্য! আর এজন্যই তামাকে ভালো বিদ্যুৎ পরিবাহী পদার্থ হিসাবে বিবেচনা করা হয়।
আজ এই পর্যন্তই, পরের টিউটোরিয়ালে আমরা বিভব পার্থক্য বা ভোল্টেজ নিয়ে বিস্তারিত জানবো।
আল্লাহ হাফেজ।